含能材料燃烧热的测定研究虚拟仿真实验
“含能材料燃烧热的测定研究虚拟仿真实验”于2018年获批国家级虚拟仿真项目
实验目的
1.以生为本,凝练理念
坚持以学生为中心的教学理念,创新实验教学方法,利用虛拟仿真实验技术和"任务驱动”探究式教学模式等辅助实验教学,延伸实验教学的时间和空间,调动学生参与实验教学的积极性和主动性,提升实验教学质量。
2.虚实结合,提升技能
以我校应用化学省级实验教学示范中心的真实实验环境和设备为基础,实验项目虚实结合,学生通过虚实结合的实验演练 ,建立起对实验直观认识,了解量热实验的测量技术;掌握氧弹热量计的构造、原理和使用方法。完成含能材料燃烧热测定完整过程操作方法的训练;学会用雷诺图解法校正温度的改变值;完成含能材料燃烧热测定实验的设计及实施。
3.夯实基础,激发潜能
燃烧热是热化学中的重要数据之一,燃烧热的测定实验 具有很强的实用性,可用于测量运载火箭用的推进剂、石油、煤、燃料油等的热值,以此判别燃料的质量,在食品和生物学中用以计算营养成分的热值,指导营养滋补品配方的确定, 还可用于计算生成热、反应热等。通过虚实结合的设计实验的实施,可加深对物理化学基本理论的理解,激发了学生的学习兴趣和潜能,增强了学生解实际问题的能力和创新创造能力。
实验原理
1.燃烧热与热量法
根据热化学的定义, 1 mol物质完全氧化时的反应热称为燃烧热。完全氧化对燃烧产物有明确的规定。例如,有机化合物中的碳氧化成二氧化碳,硫氧化成二氧化硫气体等。燃烧热的测定,除了有其实际应用价值外,还可以用于求算化合物的生成热、键能等。燃烧热的测定可以在恒容或恒压条件下进行。在恒容条件下测得的燃烧热称为恒容燃烧热Qv ,恒容燃烧热等于热力学能变ΔU。恒压条件下测得的燃烧热称为恒压燃烧热Qp ,恒压燃烧热等于焓变ΔH。若把参加反应的气体和反应生成的气体作为理想气体处理,则它们之间存在以下关系:
ΔH=ΔU +RTΔn
Qp=Qv +RTΔn
Δn式中为反应前后气相物质的物质的量之差, R为摩尔气体常数, T为反应时的热力学温度。
2.氧弹热量计测定原理
燃烧热通常用氧弹热量计测定,图1是 氧弹热量计示意图。氧弹热量计由内、外两筒组成,外筒盛满处于室温的水,于保持环境温度恒定;内筒用于盛放吸热用的纯水、燃烧样品的关键部件“氧弹”等。内、外筒之间用空气隔离。
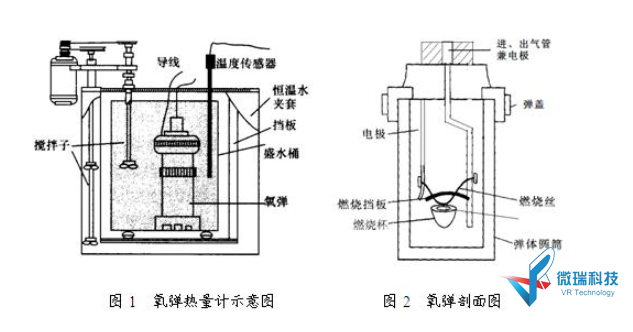
氧弹热量计的测定原理是将一定量待测样品在氧弹中完全燃烧,燃烧时放出的热量使得氧弹本身及其周围的介质和热量计有关附件的温度升高。通过测量样品在燃烧前后热量计温度的变化值, 即可通过下式计算出该样品的燃烧热。因样品在氧弹中燃烧, 容积不变,所以测出的是恒容燃烧热Qv。
W样Qv- W丝Q引燃丝= ( W水C水+C计)ΔT
式中, W样为样品的质量; W丝为引燃用的金属丝的质量; Wx为以水作为测量介质时水的质量; Qv为样品恒容燃烧热; Q引燃丝为引燃用的金属丝的恒容燃烧热; C水为水的比热容; C计为热量计的热容; ΔT为样品燃烧前后内筒水温的变化值。
设C=( W水C水+ C计)为量热系统(包括内水筒、氧弹、测温器件、搅拌器和水)的总热容。其值可由已知燃烧热的苯甲酸标定,求出量热系统的总热容C后,再用相同方法对待测样品进行测定,测出温升ΔT ,代入上式,即可求得其燃烧热。
3.雷诺图解法校正温度的改变值
实验过程中,热量计与周围环境的热交换无法完全避免,即可以是由于环境辐射和搅拌造成量热计的温度升高,也可以是热量计向环境辐射出热量而使其温度下降,因此燃烧前、后温度的改变值不能直接准确的测量,它对温度测量的影响可用雷诺温度校正图进行校正。
( 1 )将燃烧前、后观察所得的一系列水温和时间作图,如图3所示,联成ABOCD曲线。B对应的温度是开始燃烧的温度, C点对应的温度是观测到的最高温度读数点;
(2 )量取BC两点间垂直距离,即为反应前后温度变化值OT1 ;
(3 )通过ΔT1的中点K作平行横轴的直线,交曲线于0点;
( 4 )过0点作平行纵轴的直线分别交于CD的延长线E点交AB线的延长线于G点, EH线代表校正后的真正温度改变值ΔT。
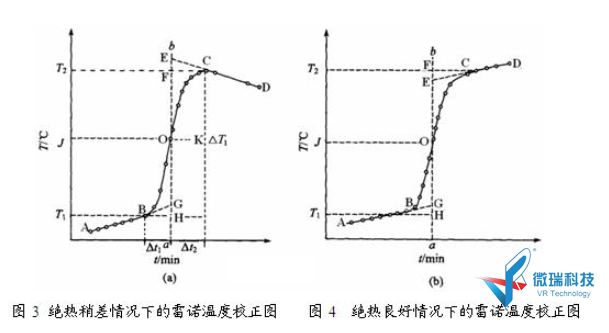
图中GH为开始燃烧到体系温度上升至环境这一段时间Δt1内,由环境辐射和搅拌引进的能量所造成的升温,故应予扣除。EF是由环境升到最高点C这一段时间 Δt2内,热量计向环境辐射出能量而造成的温度降低,必须添加,由此可见EG两点的温度差较客观地表示了样品燃烧后,热量计温度升高的值。
有时热量计绝热情况良好,但由于搅拌不断引入少的量能量,使燃烧后的最高点不出现,如图4所示,ΔT仍可按相同原理校正。
上一篇:食品类

 售前咨询专员
售前咨询专员
